抗体-药物偶联物(ADCs)已成为实体和血液系统恶性肿瘤的一类公认的抗癌药物,主要作为单一药物获得监管部门的批准。尽管广泛的临床努力开发合理的基于ADCs的组合,但迄今为止,只有有限数量的药物证明比标准治疗能改善生存。ADCs*有吸引力的联合物质是那些对肿瘤细胞或其微环境提供加性或协同作用而没有不可接受的重叠毒性的药物。与抗血管生成化合物,HER2靶向药物,DNA损伤反应剂和免疫检查点抑制剂(ICIs)共同给药是积极的先驱。
通过鉴定具有肿瘤特异性表达的靶标,改进的偶联技术,以及提供优越治疗指标的新型连接物和有效载荷,下一代ADCs为组合方法带来希望。
基于ADCs结合物的介绍和基本原理
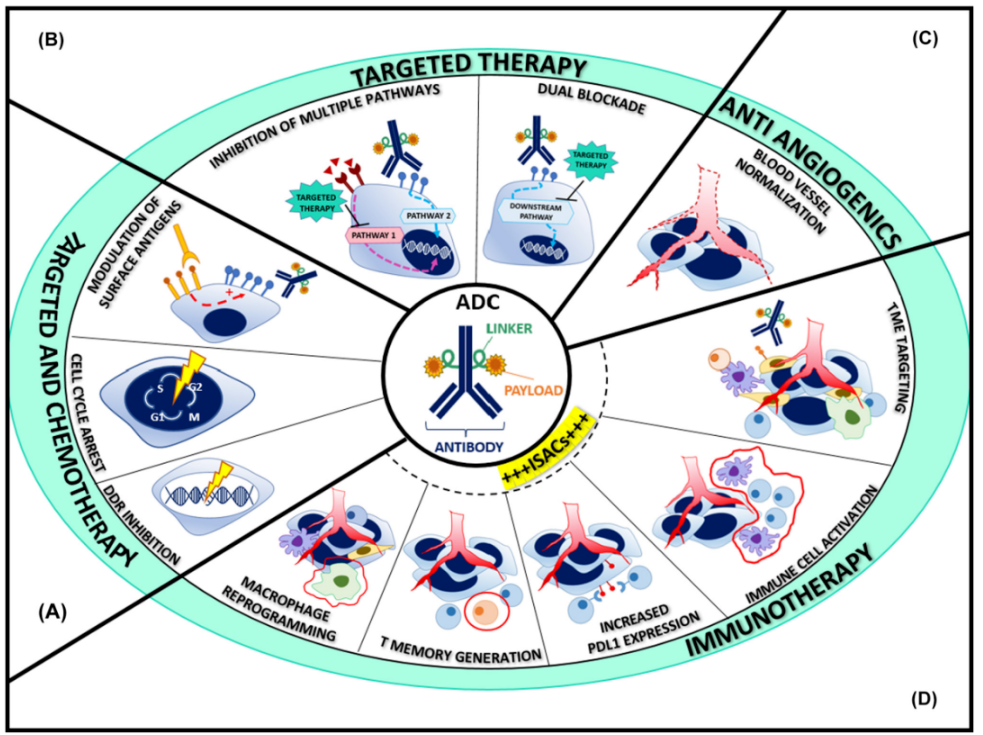
ADCs的独特结构由抗体(或抗体片段)、化学连接物和细胞毒性有效载荷组成,为这类治疗性生物产品提供了靶向性和效力。*近许多综述对这种作为单一疗法的新兴药物类别提供了全面的观点。然而,与大多数细胞毒药一样,由于耐药机制的出现,ADCs作为单一疗法产生的客观反应或临床益处的持续时间是有限的。因此,ADCs与包括化疗、分子靶向药物和免疫治疗在内的其他抗癌药物的组合正在临床前模型和临床试验中进行积极的研究。
ADCs是一类新的靶向治疗药物,由单抗(mAb)骨架通过化学连接物共价连接到细胞毒性化疗上。ADCs平台旨在通过在同种抗原相互作用时释放细胞毒性有效载荷来提高治疗指数并将靶外毒性降至*低。基于携带常规化疗药物的小鼠单抗的早期ADCs的临床发展因其显著的免疫原性、次佳的靶点选择性和狭窄的治疗窗口而受到阻碍。大多数现代的ADCs都建立在IgG1支架上,这种支架具有更好的溶解性和更长的半衰期,并将非特异性免疫原性降至*低。此外,其中一些胞外表位具有致癌功能。目前可用的连接体分为可切割的和不可切割的,分别由细胞外酸性环境、蛋白质分解或谷胱甘肽水平升高或细胞内溶酶体降解引起。虽然不可切割的连接体在循环中更稳定,但可切割的连接体会增加旁观者效应,通过这种效应,邻近的细胞会被从靶向肿瘤细胞扩散的细胞毒药物分子杀死。*后,ADCs被设计为携带高度有效的化疗药物,由于不可接受的毒性,这些药物不能以自由形式全身输注。大多数现代ADCs的有效载荷是微管蛋白干扰物、拓扑异构酶I抑制剂或DNA损伤剂。DAR的定义是结合在特定mAb上的有效载荷分子的平均数量,它对药物疗效和新陈代谢具有重要影响,DAR越高,体外活性越强,但体内清除血浆的速度更快。有效载荷的格局正在逐步纳入免疫刺激剂等新化合物,这些化合物促进了从免疫耐受剂向免疫观察TME的转变。
目前,ADCs已被批准与化疗/化学免疫疗法相结合用于血液系统癌症。能够通过靶向不同的肿瘤克隆而不重叠毒性来克服这两种药物的原始或获得性耐药性的药物组合是*有吸引力的开发药物。例如,能够增强靶抗原表达和*大限度地减少靶抗原下调,减少非特异性吞噬介导的ADCs摄取,去激活反馈环,抑制相反的生存途径,实现更高的DAR,而不增加疏水性或过早释放货物,以及促进靶细胞中的旁观者效应,这些方法将是基于ADCs的组合的强大潜在合作伙伴。