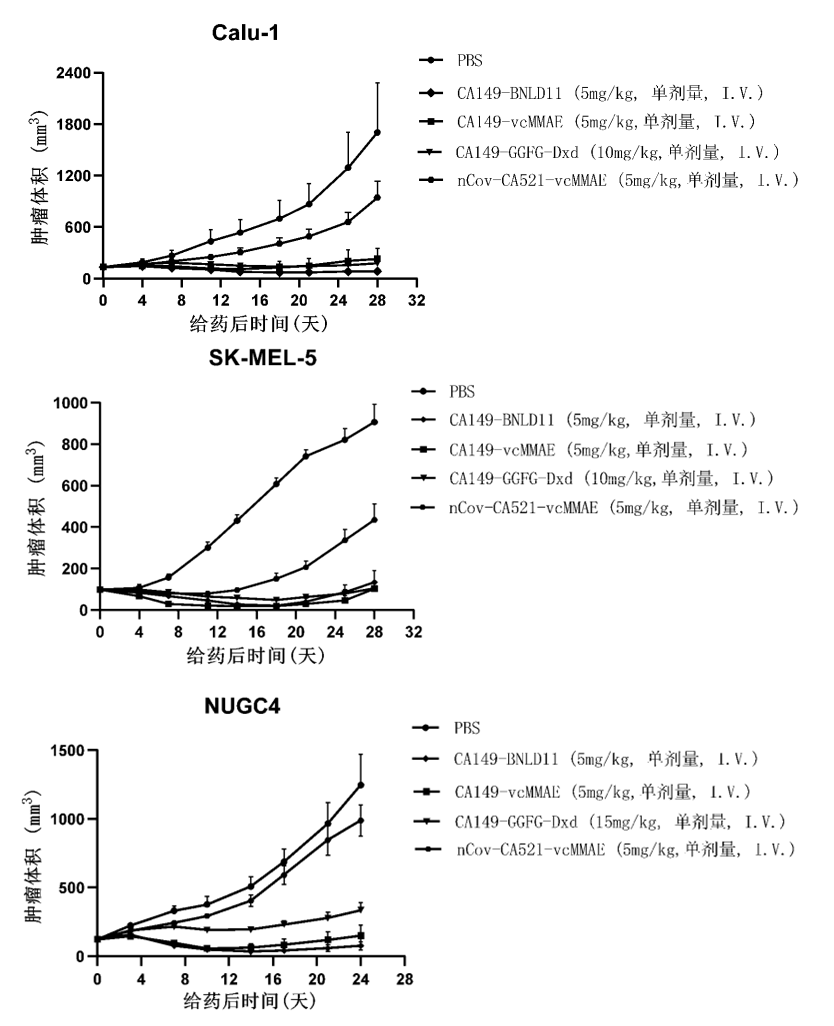
根据药物临床试验登记与信息公示平台显示,博安生物已开启评价注射用BA1302在晚期恶性实体瘤患者中的安全性、耐受性、药代动力学特征和初步疗效的1期临床试验。BA1302是国内首个获批进入临床阶段的、靶向CD228的创新型ADC药物。试验主要目的:评价注射用BA1302在晚期恶性实体瘤患者中的安全性和耐受性,观察剂量限制性毒性(DLT),确定*大耐受剂量(MTD)和II期临床试验推荐剂量(RP2D)。次要目的:评价注射用BA1302在晚期恶性实体瘤患者中的药代动力学(PK)特征、免疫原性及初步疗效。探索性目的:评价CD228表达水平与BA1302疗效的相关性。BA1302是一种靶向CD228的创新型ADC药物,博安生物曾表示,其有望成为国内“first-in-class”的产品。 CD228蛋白是首次在黑色素瘤中发现的GPI锚定糖蛋白,在肿瘤迁移和增殖中发挥作用。该蛋白靶点在黑色素瘤、间皮瘤、结肠癌、乳腺癌、胰腺癌和非小细胞肺癌等多种肿瘤中高表达,并在正常组织中低表达,具有较高的肿瘤表达特异性。BA1302的抗体部分筛选自博安生物自有知识产权的全人抗体转基因小鼠BA-huMab®,该抗体具有更好的结合特异性,只结合膜形式的CD228而不结合其可溶形式sMFI2。化学部分采用博安生物筛选的连接子-载荷(BNLD11),具有优异的体内外稳定性。BA1302采用半胱氨酸偶联技术,DAR值约为4。其连接子(linker)为MC-β-Ala-(glucuronide)PAB,载荷(payload)采用微管蛋白抑制剂单甲基澳瑞他汀E(MMAE)。临床前研究显示,BA1302在肺癌、胃癌及黑色素瘤等肿瘤模型中表现出优异的肿瘤抑制效果,且在食蟹猴毒理预实验中安全耐受性良好,其MTD剂量高于10 mg/kg, 展现出优异的临床治疗潜力。目前,国内尚无同靶点ADC药物进入临床阶段。国际上Seagen的一款CD228 ADC药物SGN-CD228A处于1期临床阶段,其抗体部分hL49靶向CD228,荷载单甲基auristatin E(MMAE,微血管蛋白抑制剂)。结合活性上,SGN- CD228A的抗体hL49与CD228的亲和力为1.31*10E-10。SGN-CD228A在多种剂量和肿瘤类型的 CDX 小鼠模型中具有体内抗肿瘤活性动物药效上,SGN- CD228A在不同细胞系的CDX模型上均显示出了明显抑制肿瘤效率。为促进抗体行业的交流与创新,2024年10月16-17日第七届金秋十月抗体产业发展大会如约而至。会议旨在为研究人员提供一个互动交流的平台,有助于推动抗体产业的进一步发展。