1 月 29 日,阿斯利康宣布,**三共/阿斯利康递交的 Enhertu 补充生物制品许可申请(sBLA)获 FDA 受理并获优先审查资格,用于治疗既往接受过治疗或没有令人满意的替代治疗方案的不可切除或转移性 HER2 阳性实体瘤的成人患者。
本次申报主要基于 DESTINY-PanTumor02 II 期临床试验数据。
去年 7 月,**三共宣布 DESTINY-PanTumor02 研究的主要分析结果显示,Enhertu(DDS-8201)在既往接受过治疗的多种 HER2 表达晚期实体瘤患者中实现临床意义上的无进展生存期(PFS)和总生存期(OS)改善。这是该试验的两个次要终点。
结果显示,根据研究者评估确认的客观缓解率(ORR)(主要终点)和缓解持续时间(DoR)(次要终点),Enhertu 继续显示出持久的缓解,强化了 2023 ASCO 年会上公布的中期分析结果。 在安全性方面,观察到与 Enhertu 此前其他试验一致,未发现新的安全问题。间质性肺疾病(ILD)发生率和严重程度与 ENHERTU 其他试验中观察到的结果一致,经独立评审委员会认定,5 级 ILD 发生率较低。 DESTINY-PanTumor02 研究是一项 Enhertu 针对 HER2 阳性(IHC 3+ 或 2+)实体瘤疗效的 II 期临床研究。此前中期分析结果显示,总人群 的 ORR 为 37.1%,中位 DoR 长达 11.8 个月,12 周的 DCR 达到 68.2%;在宫颈癌、子宫内膜癌、卵巢癌、胆道癌、膀胱癌中均观察到较大程度的疾病缓解。IHC3+ ORR为61.3%。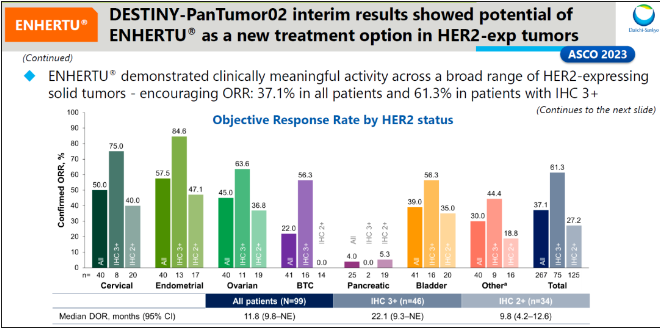
当前,**三共已经开始将 Enhertu 的研发转向泛癌种。在 2023 ASCO 年会上,除公布此项数据外,还公布了 HERALD/EPOC1806 研究*新结果。
该研究则是旨在评估 Enhertu 在通过血浆游离DNA(cfDNA)识别 HER2 扩增的晚期实体瘤中的疗效。会上公布的结果显示,Enhertu 在多种实体瘤中的总体 ORR 为 56.5%,mDOR 为 8.8 个月,mPFS 为 7 个月,mOS 为 14.6 个月。